Part 1
引言
工艺用水主要分为饮用水、纯化水、注射用水和灭菌注射用水。工艺用水的制备根本目的是控制生产过程中的颗粒物负荷与微生物负荷。工艺用水的常用水质指标有物理指标和化学指标[1]。
我司生产药品剂型主要包括固体(片剂、胶囊剂、颗粒剂)和口服糖浆,剂型决定了我司工艺用水主要涉及饮用水和纯化水。纯化水日常监测项目中,物理指标主要有:性状(臭、味、色泽)、电导率、不挥发物等;化学指标主要有:酸碱度、氯、硝酸盐、亚硝酸盐、总有机碳、内毒素、微生物限度、化学需氧量等。
纯化水在生产中可参与整个固体制剂和口服糖浆剂生产过程,可作为溶剂、配料、实验用水、器具清洗用水等,可见纯化水是非常重要的公用系统。我司采用的纯化水制备工艺是两级反渗透,具体工艺流程为:原水→原水加压泵→多介质过滤器→活性炭过滤器→软水器→保安过滤器→一级反渗透→pH调节→中间水箱→二级反渗透→纯化水箱→纯水泵→微孔过滤器→紫外灯杀菌器→各用水点。
Part 2
纯化水制备系统简介
纯化水系统是一个非常关键的公用系统,在GMP整个管理中有着举足轻重的意义。纯化水制备工艺主要有两种方式:两级反渗透和一级反渗透+EDI。反渗透是指在浓度高的一侧加一定压力,使水从浓度高的一侧向浓度低的一侧流动。EDI又称连续电子除盐,它将电渗析技术和离子交换技术结合,在电场的作用下,使离子定向迁移,达到水深度净化除盐的目的。
反渗透+EDI组合制纯化水,水质更好、设备紧凑、无酸碱污染,但EDI设备投入大;两级反渗透系统组装简便,运行费用低,技术成熟稳定。结合实际情况,我司采用两级反渗透的制备工艺,排列型式为“7+4”模式。即一级反渗透采用7根海德能RO膜,二级反渗透采用4根海德能RO膜,每小时纯水产水量为1 t。中间水箱和纯化水箱均为SUS304不锈钢材质的1 t储罐。该套系统于2007年投入使用至今,日常维护到位,整体运行状况良好,纯化水质符合内控标准,产水量和储水量均可满足日常药品生产需求。
Part3
改造背景
近年来,我司口服糖浆销售订单逐年增加,原糖浆配制罐容积为400 L,根据销售订单需求,将400 L配制罐更换成1 000 L。生产安排时,在完成配制后会立即对罐体和洁净室清场,紧接着进行后续批次产品的配制工序。这样的连续生产可以有效增加产量,但对纯化水需求量增大很多。现有纯化水储水量和制备产水量无法保障改造后的生产需求纯水用量。
综合考虑费用投入、实际用水需求和改造工期等因素,决定增大纯化水储水量,预留足够缓冲时间,制备产水量不作大的改动,通过增加周转循环储水量来满足瞬时用水量大的需求。
既已落实改造计划,则对以往制备系统中需改进的部位均进行改造,确保系统持续满足最新版GMP的要求和质量管理理念。
现将需改进的问题汇总如下:
1)储水罐容积不足。纯化水用量高峰时段,系统产水和存水量不能正常供应各使用点使用。
2)RO膜壳体老化。RO膜壳体采用不锈钢材质、一壳一芯的安装形式,两侧封头已明显老化,密封性能下降。
3)制备系统支架腐蚀现象。反渗透设备支架为镀锌方管材质,已有腐蚀现象,不符合卫生洁净要求。
4)微孔过滤器。在纯化水储罐和紫外灯灭菌器之间安装0.22 μm微孔过滤器,是多年之前的常规安装方式,但近年来质量管理理念已进一步提升,考虑问题更加全面。若不能及时对微孔过滤器进行清洁、消毒或更换,很容易造成纯化水的二次污染。
5)制备系统配管布局凌乱。各介质流向不能做到清晰明了。
6)回水总管无流量传感器。未安装流量传感器,不能反映管道内纯化水流量及流速参数信息,不能对系统进行实时动态监测。
7)电气控制老化。反渗透装置中电控箱内各电子元件使用年限太久,明显老化且配置略低,自动化程度低,不能更好地服务于系统运行。
8)清洗水箱尺寸结构不合理。化学清洗水箱容积有500 L,配置偏大,占用纯化水站室内空间,使用时无须这么大的容积;并且水箱为平底,无排污阀门,使用不便利。
9)系统无在线电导率传感器。在系统上未安装在线电导率传感器,不能实时监测重要点位的电导率,水质情况反映不及时。
10)普通呼吸器。呼吸器的主要作用是隔绝外界颗粒物和微生物对罐内水质的影响,一般孔径为0.22 μm,材质为四氟乙烯PTFE。我司一级储水罐和二级储水罐安装普通呼吸器,存在一定的质量风险。改造前纯化水工艺流程如图1所示。

图1 改造前纯化水工艺流程
Part 4
改造方案
结合纯化水实际需求情况和制备系统待进一步升级改造的多方面因素,制订了纯化水的改造方案。
1)增加储水罐容积。为了满足最大峰值的用量要求,根据批生产用水量、纯化水产水量等因素计算得出将储水箱容积增大至2 t即可,可作为用水高峰期间的缓冲调节。原有1 t纯水储罐仍旧利用,并排增加同样规格(罐体高度、罐底、直径、容积等参数)的1 t纯水储罐,总储水容积可达2 t。通过这种方式增加储水容积的优势有:可缩短改造工期,成本比更换成2 t储罐更加低,可有效分散储水后的罐体对楼层承载负荷(楼层为20世纪80年代预制板),罐体高度适宜等。后期调试时,需要将两个罐体的进出水流量调整一致,确保两个罐体动态容积基本相同,便于日常使用和质量管理。

图2 改造前RO膜排列结构图
2)RO膜壳体更换。将RO膜壳体更换成玻璃钢材质、一壳两芯安装方式。原RO膜共有11根,一级RO膜和二级RO膜采用7:4排列方式,如图2所示。本次改造采用6根玻璃钢壳体,即有12根RO膜,其中一级反渗透4个玻璃钢壳体计8根RO膜,二级反渗透2个玻璃钢壳体计4根RO膜。一级RO膜采用2:1:1结构排列,二级RO膜采用1:1结构排列,如图3所示。即:原水通过立式高压泵输送至1#和2#RO壳体,产生淡水进入一级水储罐;1#和2#产生浓水进入3#壳体,产生淡水进入一级水储罐;3#浓水进入4#壳体,产生淡水进入一级水储罐;4#产生的浓水排入污水管道不再回收利用;通过立式高压泵将一级储罐内水输送至5#RO壳体,产生淡水进入纯化水储罐;5#浓水进入6#壳体,产生淡水进入纯化水储罐;6#浓水排入原水箱,后续再过滤回收利用。通过RO膜排列方式改变,一级RO膜产水率可从之前的50%提高至75%,二级RO膜产水率可从之前的75%提高至85%。
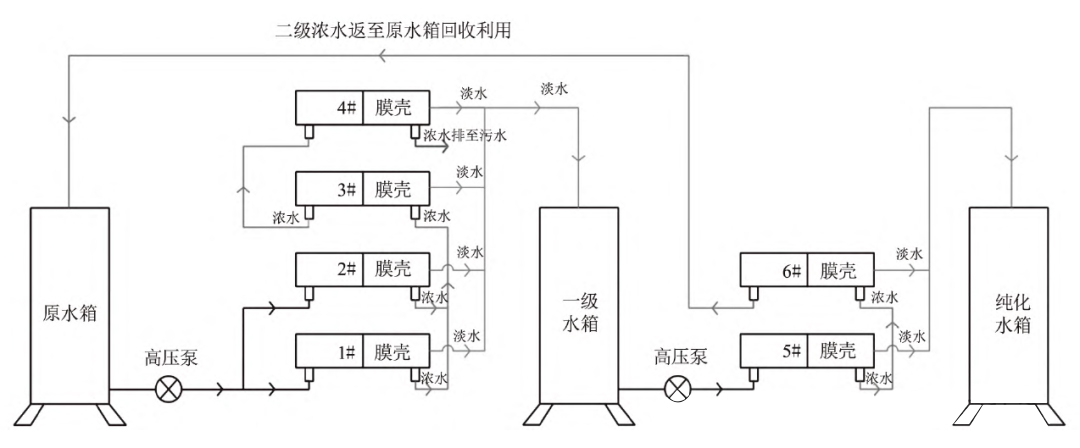 图3 改造后RO膜排列结构图
图3 改造后RO膜排列结构图
3)制备系统支架更换。支架采用SUS304不锈钢材质加工制作,再将RO膜壳体、管道、高压泵、仪表、操作面板等附属件固定依附其上。
4)取消微孔过滤器。随着质量管理理念进一步提升,考虑问题更加全面,纯化水储罐和紫外灯灭菌器之间原安装0.22 μm微孔过滤器,如日常运维时不能及时对其进行清洁、消毒或更换,很容易造成纯化水的二次污染,增加质量风险,故拆除微孔过滤器,无须配置。
5)制备系统配管优化。纯化水站室内空间有限,对各设施摆放位置及管道连接进行优化调整,确保空间合理利用,便于日常操作生产。依据中国GMP(2010版)第五章第六节第九十八条“管道的设计和安装应当避免死角、盲管”[2],焊接符合洁净管道焊接标准和检验标准。对各管道内介质和流向标志清晰。
6)回水总管增加流量传感器。安装于回水总管末端,监测回水管道流速,正常情况下末端回水流速应不低于1 m/s,确保纯化水系统水循环处于湍流状态,可防止生物膜的形成。若流速过高,则会产生振颤现象;回水流速控制在1~2 m/s为最佳。设置流量传感器监测到的流速低于1 m/s时发出报警,操作人员及时检查用水点情况并采取对应解决措施。
7)电气控制升级。反渗透装置中电控箱内各电子元件更新,增加“自动”和“手动”多种模式切换功能。依据中国GMP(2010版)第五章第六节第一百条“应当对制药用水的水质进行定期监测”[2],增加在线测温功能、在线pH监测功能;增加罐内纯化水量监测功能等。
8)清洗水箱更换。考虑到清洗水箱使用需求和空间限制,将清洗水箱更换成200 L锥形底的PP材质水箱,底部设有排污阀。
9)增加在线电导率传感器。在纯水制备系统上增加5个点位的在线电导率传感器,分别为原水箱内、一级RO膜产水、二级RO膜产水、两个纯化水储罐。同时在二级反渗透出水点位的电导率传感器上配套安装电磁阀,设置电导率值高于2 μS/cm时,旁通阀门自动打开,产水自动排污,不进入纯化水储罐,确保进入纯化水储罐的水质满足内控质量标准。
10)采用电加热呼吸器。日常纯化水系统运行时,会定期进行纯化水系统巴氏消毒,采用电加热夹套式呼吸器,并设有自排口,可保持呼吸器干爽,避免冷凝水集聚在滤膜上堵塞呼吸器,并且可避免呼吸器微生物超标的风险。
改造后纯化水工艺流程如图4所示。

图4 改造后纯化水工艺流程
结合制水系统发展趋势和改造时间、费用等成本,综合考虑确定该改造方案,符合我司实际情况,并能较好满足改造前各项需求。
纯化水制备系统是制药厂公用系统中较重要的组成部分,本次改造中也同步对纯化水系统进行了保养,比如更换石英砂、活性炭、阳树脂、保安过滤器滤芯等。运行前,对整个系统进行了酸洗钝化和巴氏消毒等工序,确保产水和分配系统环节符合质量标准。
经改造或重大维修的设备应该进行再确认,因此,对改造后的纯化水系统进行安装确认、运行确认和性能确认等验证工作,通过验证判断设备能否持续生产符合质量标准的纯化水,能否供应得上生产用水量,能否保证分配系统有效输送和储存纯化水等。纯化水系统验收周期较长,若水质符合《中国药典》和内控标准,可在出阶段性验证报告后进行生产活动,后期验证工作持续进行。
Part 5
结束语
纯化水系统制备工艺有多种方式、多种组合,企业选择适合的制备工艺,既能保证产水水质符合质量标准,也能达到降本增效且环保的目的。
尽管我国的制药生产设备及技术发展已经比较成熟,但企业考虑到资金投入成本、改造时间成本,仍会想尽量利用原有设备主机。在这一前提下,为保证设备持续符合法律法规和生产工艺的要求,就需要企业的技术人员量身定制出合理的改造方案,使设备更好地为药品生产提供保障,这也使得企业和整个行业对相关从业人员提出了更高的要求、更多的期盼。
参考文献
[1] 何国强.制药流体工艺实施手册[M].北京:化学工业出版社,2013.
[2] 药品生产质量管理规范(2010年修订):卫生部令第79号[A].


 图3 改造后RO膜排列结构图
图3 改造后RO膜排列结构图
